酒石酸托特罗定缓释胶囊
酒石酸托特罗定缓释胶囊,适应症为本品适用于治疗膀胱过度活动症,其症状可为尿急、尿频、急迫性尿失禁。
基本介绍
- 药品名称:酒石酸托特罗定缓释胶囊
- 药品类型:处方药、医保工伤用药
- 用途分类:泌尿道解痉药
成份
本品主要成份为酒石酸托特罗定。其活性成份托特罗定是一种毒蕈硷受体拮抗剂。酒石酸托特罗定的化学名称:(R)-N,N-二异丙基-3-(2-羟基-5-甲苯基)-3-苯丙醇胺L-氢酒石酸。
化学结构式:
化学结构式:
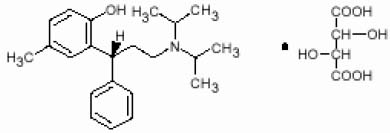
分子式:C26H37NO7
分子量:475.6
性状
本品为硬胶囊,内容物为白色至类白色的球形小丸。
适应症
本品适用于治疗膀胱过度活动症,其症状可为尿急、尿频、急迫性尿失禁。
规格
(1)2mg(2)4mg
用法用量
托特罗定缓释胶囊的推荐剂量为4mg,每日一次,用水将药物完整吞服。根据患者的疗效和耐受性,该剂量可以减至每日2mg。但本品2mg 治疗的疗效数据尚有限(参见【临床
试验】)。
对于肝功能或肾功能明显减退的患者,或者正在使用CYP3A4 酶强效抑制剂的患者,推荐剂量为每日2mg(参见【药理毒理】的“临床药理学”和【注意事项】的“药物相互作用”)。
试验】)。
对于肝功能或肾功能明显减退的患者,或者正在使用CYP3A4 酶强效抑制剂的患者,推荐剂量为每日2mg(参见【药理毒理】的“临床药理学”和【注意事项】的“药物相互作用”)。
不良反应
在Ⅱ期和Ⅲ期临床研究中入组患者1073 例,随机分配到托特罗定缓释胶囊组(n=537)或安慰剂组(n=536)。治疗剂量为2,4,6 或8mg/日,疗程最长达15 个月。因为开展的各个临床研究的条件不同,所以一个药物临床研究中观察到的不良反应发生率不能与另一个药物临床研究中观察到的不良反应发生率进行直接比较,也可能不能反映临床实践中所观察到的不良反应发生率。但是,临床研究中得到的不良反应数据为发现与药物相关的不良事件和估计不良事件发生率奠定了基础。以下数据反映的是Ⅲ期临床对照研究中,托特罗定缓释胶囊组(n=505,4mg,每日1 次,晨服)和安慰剂组(n=507),治疗12 周的不良事件的情况。
本品治疗组有52%的患者(n=263)报告了不良事件,安慰剂组有49%(n=247)的患者报告了不良事件。治疗组报告的最常见不良事件是口乾、头痛、便秘和腹痛。口乾是套用
本品治疗的患者中最常见的不良事件,发生率为23.4%,安慰剂组的发生率为7.7%。口乾、便秘、视觉异常(调节功能异常)、尿潴留和乾眼病都是抗毒蕈硷剂的预期副作用。严重不良事件发生率:托特罗定缓释胶囊组为1.4%(n=7),安慰剂组为3.6%(n=18)。
由于不良事件导致停药的比例在治疗的最初4 周中最高。治疗组和安慰剂组由于不良事件而停止治疗的患者比例相似。因口乾而退出治疗的患者:治疗组为2.4%(n=12),安慰剂组为1.2%(n=6)。
表1 显示的是在为期12 周的Ⅲ期临床对照研究中用托特罗定缓释胶囊4mg,每日1 次治疗的患者中发生率≥1%的不良事件。所报告的这些不良事件并非均和药物相关。
上市后监测
以下为全球上市后报告的与托特罗定有关的不良事件:
全身:过敏样反应,包括血管性水肿;
心血管:心动过速;心悸;外周水肿;
胃肠道:腹泻;
中枢/周围神经系统:意识混乱,定向障碍,记忆损伤,幻觉。
使用胆硷酯酶抑制剂治疗痴呆的患者中套用托特罗定治疗时曾经出现过痴呆症状(例如:意识混乱,定向障碍,错觉)加重的报导。
由于这些自发报告的事件来自全球上市后经验,尚不能充分明确事件的发生率以及和托特罗定的相关性。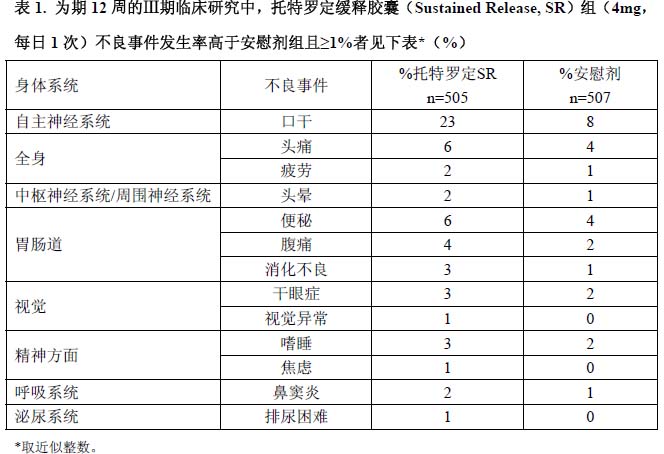
本品治疗组有52%的患者(n=263)报告了不良事件,安慰剂组有49%(n=247)的患者报告了不良事件。治疗组报告的最常见不良事件是口乾、头痛、便秘和腹痛。口乾是套用
本品治疗的患者中最常见的不良事件,发生率为23.4%,安慰剂组的发生率为7.7%。口乾、便秘、视觉异常(调节功能异常)、尿潴留和乾眼病都是抗毒蕈硷剂的预期副作用。严重不良事件发生率:托特罗定缓释胶囊组为1.4%(n=7),安慰剂组为3.6%(n=18)。
由于不良事件导致停药的比例在治疗的最初4 周中最高。治疗组和安慰剂组由于不良事件而停止治疗的患者比例相似。因口乾而退出治疗的患者:治疗组为2.4%(n=12),安慰剂组为1.2%(n=6)。
表1 显示的是在为期12 周的Ⅲ期临床对照研究中用托特罗定缓释胶囊4mg,每日1 次治疗的患者中发生率≥1%的不良事件。所报告的这些不良事件并非均和药物相关。
上市后监测
以下为全球上市后报告的与托特罗定有关的不良事件:
全身:过敏样反应,包括血管性水肿;
心血管:心动过速;心悸;外周水肿;
胃肠道:腹泻;
中枢/周围神经系统:意识混乱,定向障碍,记忆损伤,幻觉。
使用胆硷酯酶抑制剂治疗痴呆的患者中套用托特罗定治疗时曾经出现过痴呆症状(例如:意识混乱,定向障碍,错觉)加重的报导。
由于这些自发报告的事件来自全球上市后经验,尚不能充分明确事件的发生率以及和托特罗定的相关性。

禁忌
本品禁用于尿潴留、胃潴留或未得到控制的窄角性青光眼患者。也禁用于已知对本品任何成分过敏者。
注意事项
一般注意事项
尿潴留和胃潴留的风险性:由于有尿潴留的危险,本品慎用于临床上有明显膀胱流出道梗阻的患者。由于有胃潴留的风险,本品应慎用于有胃肠道梗阻性疾病,如幽门狭窄的患者(参见【禁忌】)。
胃肠蠕动减弱的患者:与其它抗毒蕈硷类药物相似,本品慎用于胃肠蠕动减弱的患者。
已控制的窄角性青光眼患者:本品慎用于正在治疗的窄角性青光眼患者。
肝功能和肾功能减退的患者:对于肝功能或肾功能明显减退的患者,建议本品的用药剂量为每日2mg(参见【药理毒理】的“临床药理学”,【药代动力学】的“特殊人群中的药代动力学”)。
重症肌无力患者:重症肌无力是一种以神经肌肉接头处胆硷能活性减低为表现的疾病,本品慎用于重症肌无力患者先天性或获得性QT 间期延长的患者有研究探讨了托特罗定速释片对QT 间期的影响(参见【药理毒理】的“临床药理学”,【药物相互作用】的“心脏的电生理”),发现8mg/日(治疗剂量2 倍)时对QT 间期的影响大于4mg/日对QT 间期的影响,对CYP2D6 弱代谢者(PM)QT 间期的影响大于对强代谢者(EM)QT 间期的影响。托特罗定8mg/日对QT 的影响小于莫西沙星服药4 日后对QT的影响。但是可信区间有重叠。对已知有QT 间期延长病史的患者或者正在服用IA 类抗心律失常药(如,奎尼丁、普鲁卡因胺)或III 类抗心律失常药物(如,胺碘酮、索他洛尔)的患者处方本品时,应考虑到这些情况(参见【注意事项】的“药物相互作用”)。托特罗定速释片及缓释剂型全球上市后经验中未发现其与尖端扭转型心律失常(Torsade de Pointes)
有相关性。
患者指南
应告知患者抗毒蕈硷类药物,如托特罗定缓释胶囊,可能产生下列反应:视力模糊、头晕或睏倦。在确定药物对患者是否会产生上述影响前,应告知患者慎重从事有潜在危险性的活动。
药物相互作用
CYP3A4 酶抑制剂:酮康唑是CYP3A4 酶的抑制剂。托特罗定的弱代谢者合用酮康唑时,会显着增加托特罗定的血浆浓度(参见【药理毒理】的“临床药理学”,【药代动力学】“代谢的变异性”和【药物相互作用】)。对于在用酮康唑或其他强效CYP3A4 酶抑制剂,如其他唑类抗真菌药(如伊曲康唑、咪康唑)、大环内酯类抗生素(如红霉素、克拉霉素)、环孢素或长春硷的患者,本品的推荐剂量为每日2mg(参见【用法用量】)。
药物和实验室检查的相互影响
未对托特罗定与实验室检查之间的相互影响进行研究。
尿潴留和胃潴留的风险性:由于有尿潴留的危险,本品慎用于临床上有明显膀胱流出道梗阻的患者。由于有胃潴留的风险,本品应慎用于有胃肠道梗阻性疾病,如幽门狭窄的患者(参见【禁忌】)。
胃肠蠕动减弱的患者:与其它抗毒蕈硷类药物相似,本品慎用于胃肠蠕动减弱的患者。
已控制的窄角性青光眼患者:本品慎用于正在治疗的窄角性青光眼患者。
肝功能和肾功能减退的患者:对于肝功能或肾功能明显减退的患者,建议本品的用药剂量为每日2mg(参见【药理毒理】的“临床药理学”,【药代动力学】的“特殊人群中的药代动力学”)。
重症肌无力患者:重症肌无力是一种以神经肌肉接头处胆硷能活性减低为表现的疾病,本品慎用于重症肌无力患者先天性或获得性QT 间期延长的患者有研究探讨了托特罗定速释片对QT 间期的影响(参见【药理毒理】的“临床药理学”,【药物相互作用】的“心脏的电生理”),发现8mg/日(治疗剂量2 倍)时对QT 间期的影响大于4mg/日对QT 间期的影响,对CYP2D6 弱代谢者(PM)QT 间期的影响大于对强代谢者(EM)QT 间期的影响。托特罗定8mg/日对QT 的影响小于莫西沙星服药4 日后对QT的影响。但是可信区间有重叠。对已知有QT 间期延长病史的患者或者正在服用IA 类抗心律失常药(如,奎尼丁、普鲁卡因胺)或III 类抗心律失常药物(如,胺碘酮、索他洛尔)的患者处方本品时,应考虑到这些情况(参见【注意事项】的“药物相互作用”)。托特罗定速释片及缓释剂型全球上市后经验中未发现其与尖端扭转型心律失常(Torsade de Pointes)
有相关性。
患者指南
应告知患者抗毒蕈硷类药物,如托特罗定缓释胶囊,可能产生下列反应:视力模糊、头晕或睏倦。在确定药物对患者是否会产生上述影响前,应告知患者慎重从事有潜在危险性的活动。
药物相互作用
CYP3A4 酶抑制剂:酮康唑是CYP3A4 酶的抑制剂。托特罗定的弱代谢者合用酮康唑时,会显着增加托特罗定的血浆浓度(参见【药理毒理】的“临床药理学”,【药代动力学】“代谢的变异性”和【药物相互作用】)。对于在用酮康唑或其他强效CYP3A4 酶抑制剂,如其他唑类抗真菌药(如伊曲康唑、咪康唑)、大环内酯类抗生素(如红霉素、克拉霉素)、环孢素或长春硷的患者,本品的推荐剂量为每日2mg(参见【用法用量】)。
药物和实验室检查的相互影响
未对托特罗定与实验室检查之间的相互影响进行研究。
孕妇及哺乳期妇女用药
妊娠
妊娠分级:C 级。口服剂量20mg/kg/日(约为人暴露量的14 倍),小鼠中未见先天畸形或异常。用药剂量30-40mg/kg/日时,发现托特罗定可致小鼠胚胎死亡,使胎鼠体重减轻,胚胎畸形的发生率升高(齶裂、指畸形、腹腔内出血和各种骨骼畸形、主要是骨化减少)。
此剂量下,AUC 值约比人体内的AUC 值高20 倍到25 倍。使用0.8mg/kg/日的剂量进行兔皮下用药,AUC 值为100μg·h/L,约比人用剂量达到的AUC 值高3 倍。该剂量没有引起任何胚胎毒性,也没有致畸性。因未在妊娠妇女中开展托特罗定研究,所以只有在对母亲的潜在受益大于对胎儿的潜在危险时,才能在妊娠期间使用本品。
哺乳期妇女
托特罗定速释片可经小鼠的乳汁排泄。哺乳期间服用托特罗定20mg/kg/日的雌性小鼠,其幼鼠的体重增加幅度略有减少。幼鼠在成熟阶段重新恢复正常体重。目前尚未知托特罗定能否分泌到人乳中,因此哺乳期间禁用本品,哺乳期妇女应当判断是否要暂停哺乳或者停用本品。
妊娠分级:C 级。口服剂量20mg/kg/日(约为人暴露量的14 倍),小鼠中未见先天畸形或异常。用药剂量30-40mg/kg/日时,发现托特罗定可致小鼠胚胎死亡,使胎鼠体重减轻,胚胎畸形的发生率升高(齶裂、指畸形、腹腔内出血和各种骨骼畸形、主要是骨化减少)。
此剂量下,AUC 值约比人体内的AUC 值高20 倍到25 倍。使用0.8mg/kg/日的剂量进行兔皮下用药,AUC 值为100μg·h/L,约比人用剂量达到的AUC 值高3 倍。该剂量没有引起任何胚胎毒性,也没有致畸性。因未在妊娠妇女中开展托特罗定研究,所以只有在对母亲的潜在受益大于对胎儿的潜在危险时,才能在妊娠期间使用本品。
哺乳期妇女
托特罗定速释片可经小鼠的乳汁排泄。哺乳期间服用托特罗定20mg/kg/日的雌性小鼠,其幼鼠的体重增加幅度略有减少。幼鼠在成熟阶段重新恢复正常体重。目前尚未知托特罗定能否分泌到人乳中,因此哺乳期间禁用本品,哺乳期妇女应当判断是否要暂停哺乳或者停用本品。
儿童用药
在儿科人群中的疗效尚未明确。
两项为期12 周的Ⅲ期随机、安慰剂对照、双盲研究中,共研究了710 例年龄5-10 岁的儿科患者(486 例服用托特罗定缓释胶囊,224 例服用安慰剂),这些患儿有尿频和急迫性尿失禁症状。本品治疗组中尿路感染者所占的比例(6.6%)高于安慰剂组(4.5%)。本品治疗组2.9%的患儿出现攻击性行为、异常和多动行为或注意力障碍,而安慰剂组0.9%的患儿有这样的行为。
两项为期12 周的Ⅲ期随机、安慰剂对照、双盲研究中,共研究了710 例年龄5-10 岁的儿科患者(486 例服用托特罗定缓释胶囊,224 例服用安慰剂),这些患儿有尿频和急迫性尿失禁症状。本品治疗组中尿路感染者所占的比例(6.6%)高于安慰剂组(4.5%)。本品治疗组2.9%的患儿出现攻击性行为、异常和多动行为或注意力障碍,而安慰剂组0.9%的患儿有这样的行为。
老年用药
托特罗定治疗的老年人和年轻人中,总体安全性上未见差异(参见【药理毒理】的“临床药理学”,【药代动力学】的“特殊人群中的药代动力学”)。
药物相互作用
氟西汀:氟西汀是选择性5-羟色胺再摄取抑制剂,也是CYP2D6 酶活性的强效抑制剂。有研究评价了氟西汀对托特罗定速释片及其代谢产物的药代动力学的影响。结果发现在强代谢者中,氟西汀显着抑制托特罗定速释片的代谢,使托特罗定的AUC 值升高4.8 倍。托特罗定5-羟甲基代谢产物的Cmax 降低52%,AUC 值降低20%。因此在对托特罗定速释片的强代谢者中,氟西汀改变了托特罗定的药代动力学,致使其药代动力学表现类似于在弱代谢者中的表现。药物相互作用期间,游离的托特罗定及其5-羟甲基代谢产物的血清浓度之和仅升高25%。托特罗定与氟西汀合用时无需调整剂量。
经细胞色素 P450 同工酶代谢的其他药物:托特罗定速释片与经主要CYP 酶类代谢的其他药物合用,不引起有临床意义的药物相互作用。体内药物相互作用资料显示,托特罗定速释片不引起有临床意义的对CYP1A2,2D6,2C9,2C19 或3A4 酶的抑制作用。证据是其对标誌药物咖啡因、异喹胍、S-华法林及奥美拉唑无明显影响。体外资料表明,托特罗定速释片在高浓度时是CYP2D6 的竞争性抑制剂(Ki 1.05μM),而托特罗定速释片及其5-羟甲基代谢产物对其他CYP 同工酶没有明显的抑制作用。
CYP3A4 酶抑制剂:在8 名健康志愿者中研究了200mg 每日1 次的酮康唑对托特罗定速释片药代动力学的影响,这8 名志愿者都是托特罗定的弱代谢者(参见【药代动力学】,“代谢的变异性”部分对弱代谢者的讨论)。在有酮康唑的情况下,托特罗定的平均Cmax 和AUC分别升高2 倍和2.5 倍。根据这些发现,其他强效CYP3A4 酶抑制剂,如其他唑类抗真菌剂(如,伊曲康唑、咪康唑)、大环内酯类抗生素(如,红霉素、克拉霉素)、环孢素或长春硷,也都可能导致托特罗定血浆浓度的升高(参见【注意事项】和【用法用量】)。
华法林:在健康志愿者中,托特罗定速释片4mg(2mg,每日2 次)用药7 日,第4 日合用单剂华法林25mg,对凝血酶原时间、因子VII 抑制作用以及华法林的药代动力学均无影响。
口服避孕药:为期2 个月的监测健康女性志愿者炔雌醇和左旋炔诺孕酮的结果显示托特罗定速释片4mg(2mg,每日2 次)对口服避孕药(炔雌醇30μg/左旋炔诺孕酮150μg)的药代动力学没有影响。
利尿剂:托特罗定速释片与利尿剂如吲达帕胺、氢氯噻嗪、氨苯蝶啶、苄氟噻嗪、氯噻嗪、甲基氯噻嗪或呋塞米合用,最大剂量达8mg(4mg,每日2 次),最长12 周时间,对心电图(ECG)没有任何负面影响。
心脏电生理:
在18-55 岁的健康男性(n=25)和女性(n=23)志愿者中,进行了一项4 相交叉的双盲、安慰剂和活性药物(莫西沙星400mg QD)对照的研究,评价了托特罗定速释片2mg,每日2 次,和4mg,每日2 次用药后,对QT 间期的影响。研究受试者[CYP2D6 强代谢者(EM)和弱代谢者(PM)的人数大致相等]完成了先后的4 日给药期,分别是莫西沙星400mg,每日1 次,托特罗定2mg,每日2 次,托特罗定4mg,每日2 次和安慰剂。选择4mg,每日2次的托特罗定速释片(最高推荐剂量的2 倍)是因为该剂量用药后的托特罗定暴露量类似于CYP2D6 弱代谢的患者中托特罗定2mg,每日2 次与强效CYP3A4 酶抑制剂合用情况下所观察到的暴露量(参见【注意事项】的“药物相互作用”)。用药后测量了12 个小时期间的QT 间期[包括托特罗定达到血浆峰浓度的时间(Tmax)]以及达到稳态的情况下的QT 间期(用药第4 天)。
表2 总结了从基线到稳态期间在Tmax 时,托特罗定和莫西沙星与安慰剂比较对QTc的影响。用Fridericia 法(QTcF)和人群特异性(QTcP)方法根据心率校正QT 间期。目前尚未证实哪种QT 校正方法更有效。QT 间期通过人工和机器测量,两种测量方法得到的数据都列于下表。该研究中托特罗定4mg/日的剂量相应的心率平均增加幅度为2.0 次/分钟;托特罗定8mg/日剂量时,心率平均增加6.3 次/分钟。用莫西沙星时的心率改变是0.5 次/分钟。
表2:从基线到稳态(用药第4 天)Tmax 时QTc 变化的平均值(CI)(与安慰剂相比)
QT 间期机器读数和人工测量读数之间存在差异,其原因不明。托特罗定速释片在8mg/日(治疗剂量的2 倍)剂量下对QT 的影响表现为比4mg/日剂量下对QT 的影响大。托特罗定8mg/日对QTc 的影响小于莫西沙星按治疗剂量用药4 日后对QTc 的影响。但是可信区间有重叠。
该研究发现托特罗定对QT 间期的影响与托特罗定的血浆浓度有关。托特罗定用药后,CYP2D6 酶弱代谢者中QTc 间期延长的幅度似乎比CYP2D6 酶强代谢者中QTc 间期延长的幅度大。
此研究设计的目的不是要在药物之间或者不同剂量之间进行直接的统计学比较。托特罗定速释片或缓释胶囊全球上市后经验中未发现其与尖端扭转型心律失常(Torsade dePointes)有关联。(参见【注意事项】的“先天性或获得性QT 延长的患者”)。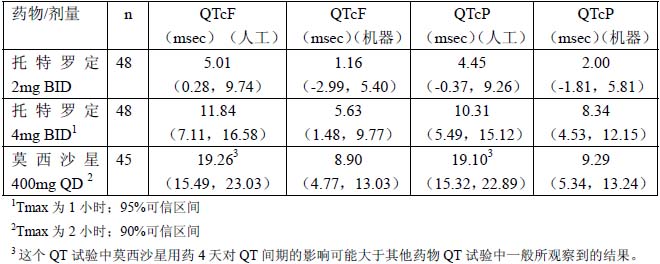
经细胞色素 P450 同工酶代谢的其他药物:托特罗定速释片与经主要CYP 酶类代谢的其他药物合用,不引起有临床意义的药物相互作用。体内药物相互作用资料显示,托特罗定速释片不引起有临床意义的对CYP1A2,2D6,2C9,2C19 或3A4 酶的抑制作用。证据是其对标誌药物咖啡因、异喹胍、S-华法林及奥美拉唑无明显影响。体外资料表明,托特罗定速释片在高浓度时是CYP2D6 的竞争性抑制剂(Ki 1.05μM),而托特罗定速释片及其5-羟甲基代谢产物对其他CYP 同工酶没有明显的抑制作用。
CYP3A4 酶抑制剂:在8 名健康志愿者中研究了200mg 每日1 次的酮康唑对托特罗定速释片药代动力学的影响,这8 名志愿者都是托特罗定的弱代谢者(参见【药代动力学】,“代谢的变异性”部分对弱代谢者的讨论)。在有酮康唑的情况下,托特罗定的平均Cmax 和AUC分别升高2 倍和2.5 倍。根据这些发现,其他强效CYP3A4 酶抑制剂,如其他唑类抗真菌剂(如,伊曲康唑、咪康唑)、大环内酯类抗生素(如,红霉素、克拉霉素)、环孢素或长春硷,也都可能导致托特罗定血浆浓度的升高(参见【注意事项】和【用法用量】)。
华法林:在健康志愿者中,托特罗定速释片4mg(2mg,每日2 次)用药7 日,第4 日合用单剂华法林25mg,对凝血酶原时间、因子VII 抑制作用以及华法林的药代动力学均无影响。
口服避孕药:为期2 个月的监测健康女性志愿者炔雌醇和左旋炔诺孕酮的结果显示托特罗定速释片4mg(2mg,每日2 次)对口服避孕药(炔雌醇30μg/左旋炔诺孕酮150μg)的药代动力学没有影响。
利尿剂:托特罗定速释片与利尿剂如吲达帕胺、氢氯噻嗪、氨苯蝶啶、苄氟噻嗪、氯噻嗪、甲基氯噻嗪或呋塞米合用,最大剂量达8mg(4mg,每日2 次),最长12 周时间,对心电图(ECG)没有任何负面影响。
心脏电生理:
在18-55 岁的健康男性(n=25)和女性(n=23)志愿者中,进行了一项4 相交叉的双盲、安慰剂和活性药物(莫西沙星400mg QD)对照的研究,评价了托特罗定速释片2mg,每日2 次,和4mg,每日2 次用药后,对QT 间期的影响。研究受试者[CYP2D6 强代谢者(EM)和弱代谢者(PM)的人数大致相等]完成了先后的4 日给药期,分别是莫西沙星400mg,每日1 次,托特罗定2mg,每日2 次,托特罗定4mg,每日2 次和安慰剂。选择4mg,每日2次的托特罗定速释片(最高推荐剂量的2 倍)是因为该剂量用药后的托特罗定暴露量类似于CYP2D6 弱代谢的患者中托特罗定2mg,每日2 次与强效CYP3A4 酶抑制剂合用情况下所观察到的暴露量(参见【注意事项】的“药物相互作用”)。用药后测量了12 个小时期间的QT 间期[包括托特罗定达到血浆峰浓度的时间(Tmax)]以及达到稳态的情况下的QT 间期(用药第4 天)。
表2 总结了从基线到稳态期间在Tmax 时,托特罗定和莫西沙星与安慰剂比较对QTc的影响。用Fridericia 法(QTcF)和人群特异性(QTcP)方法根据心率校正QT 间期。目前尚未证实哪种QT 校正方法更有效。QT 间期通过人工和机器测量,两种测量方法得到的数据都列于下表。该研究中托特罗定4mg/日的剂量相应的心率平均增加幅度为2.0 次/分钟;托特罗定8mg/日剂量时,心率平均增加6.3 次/分钟。用莫西沙星时的心率改变是0.5 次/分钟。
表2:从基线到稳态(用药第4 天)Tmax 时QTc 变化的平均值(CI)(与安慰剂相比)
QT 间期机器读数和人工测量读数之间存在差异,其原因不明。托特罗定速释片在8mg/日(治疗剂量的2 倍)剂量下对QT 的影响表现为比4mg/日剂量下对QT 的影响大。托特罗定8mg/日对QTc 的影响小于莫西沙星按治疗剂量用药4 日后对QTc 的影响。但是可信区间有重叠。
该研究发现托特罗定对QT 间期的影响与托特罗定的血浆浓度有关。托特罗定用药后,CYP2D6 酶弱代谢者中QTc 间期延长的幅度似乎比CYP2D6 酶强代谢者中QTc 间期延长的幅度大。
此研究设计的目的不是要在药物之间或者不同剂量之间进行直接的统计学比较。托特罗定速释片或缓释胶囊全球上市后经验中未发现其与尖端扭转型心律失常(Torsade dePointes)有关联。(参见【注意事项】的“先天性或获得性QT 延长的患者”)。

药物过量
一名27 个月大的儿童摄入了5-7 片托特罗定2mg 速释片,用活性炭混悬液治疗,患儿住院观察,有口乾症状。该患儿完全康复。
药物过量的处理
本品用药过量有可能会导致严重的中枢抗胆硷能作用,应当进行相应的处理。
药物过量的情况下建议进行ECG 监测。在犬中,4.5mg/kg 的超药理剂量下,观察到QT间期改变(轻微延长10%-20%),该剂量比推荐的人用剂量高约68 倍。正常志愿者和患者的临床研究中,托特罗定速释片剂量最高达8mg(4mg,每日2 次)时,观察到QT 间期延长,没有对更高的剂量进行评价(参见【注意事项】的“先天性或获得性QT 延长的患者”)。
药物过量的处理
本品用药过量有可能会导致严重的中枢抗胆硷能作用,应当进行相应的处理。
药物过量的情况下建议进行ECG 监测。在犬中,4.5mg/kg 的超药理剂量下,观察到QT间期改变(轻微延长10%-20%),该剂量比推荐的人用剂量高约68 倍。正常志愿者和患者的临床研究中,托特罗定速释片剂量最高达8mg(4mg,每日2 次)时,观察到QT 间期延长,没有对更高的剂量进行评价(参见【注意事项】的“先天性或获得性QT 延长的患者”)。
临床试验
一项Ⅱ期的量效关係研究在29 例患者中对本品2mg 进行了评价。在一项为期 12 周的随机、双盲、安慰剂对照、多中心Ⅲ期研究中,评价了本品4mg 治疗伴有急迫性尿失禁和尿频症状的膀胱过度活动症(Overactive bladder)的情况。共507 例患者接受本品4mg 每日1 次,晨服;508 例患者接受安慰剂。绝大多数患者是高加索人(95%)和女性(81%),平均年龄为61 岁(範围20-93 岁)。该研究中,642 例患者(42%)的年龄为65-93 岁。研究包括了已知用托特罗定速释片和其他抗胆硷能药物有效的患者,但是47%的患者以前从未因膀胱过度活动症而接受药物治疗。进入研究时,97%的患者每周有至少5 次急迫性尿失禁,91%的患者每日排尿≥8 次。主要疗效终点是从基线到第12 周时,每周平均尿失禁次数的变化。次要疗效终点包括从基线到第12 周时,每日平均排尿次数的变化,以及平均排尿量的变化。
表3.从基线到第12 周各指标平均变化在托特罗定缓释胶囊(4mg,每日1 次)和安慰剂之间的差别及其95%可信区间(CI)*
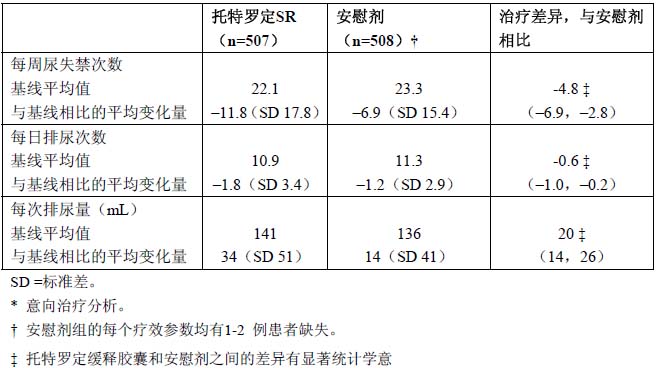
表3.从基线到第12 周各指标平均变化在托特罗定缓释胶囊(4mg,每日1 次)和安慰剂之间的差别及其95%可信区间(CI)*

药理毒理
临床药理学
托特罗定是一种竞争性的毒蕈硷受体拮抗剂。膀胱收缩和唾液分泌都是由胆硷能毒蕈硷受体介导的。
口服用药后,托特罗定在肝脏中进行代谢,形成5-羟甲基衍生物。该衍生物是有药理活性的主要代谢产物。该5-羟甲基代谢产物表现出与托特罗定相似的抗毒蕈硷活性,在药
物的治疗效应中起很大作用。托特罗定及其5-羟甲基代谢产物对毒蕈硷受体都表现出很高的特异性,因为两者对其它神经递质受体和其他潜在的细胞靶位如钙通道的活性或亲和力可以忽略不计。
托特罗定对膀胱功能有突出的作用。分别测定托特罗定速释片(Immediate Release, IR)在健康志愿者中单剂量6.4mg 用药前和用药后1 小时、5 小时,对尿流动力学参数的作用。托特罗定用药后1 小时和5 小时的主要作用是增加了残余尿量,反映了膀胱的不全排空以及逼尿肌压力的降低。这些发现与其对下尿路的抗毒蕈硷作用一致。
致癌作用、致突变作用、生育力损害
在小鼠和大鼠中对托特罗定速释片进行了致癌性研究。在小鼠(30mg/kg/日)、雌性大鼠(20mg/kg/日)和雄性大鼠(30mg/kg/日)的最大耐受剂量下,托特罗定的AUC 值分别为355,291 和462μg·h/L。相比之下,2mg 剂量每日2 次用药后,人体内的AUC 值估计为34μg·h/L。因此,致癌性研究中托特罗定的暴露量比人体用药的预计暴露量高9-14 倍。小鼠和大鼠中的肿瘤均未见增多。
整套体外试验,包括4 株鼠伤寒沙门菌和2 株大肠埃希菌中的细菌突变试验(Ames 试验),L5178Y 小鼠淋巴瘤细胞中的基因突变试验,以及人淋巴细胞的染色体畸变试验,均未见托特罗定有致突变作用。小鼠的体内骨髓微核试验中托特罗定的结果也是阴性。
交配前2 周和妊娠期间用20mg/kg/日(对应的AUC 值约为500μg·h/L)的剂量给雌性小鼠治疗,未见对雌性小鼠的生殖能力及生育力有影响。根据AUC 值,动物的全身暴露量
约比人体暴露量高15 倍。雄性小鼠中,30mg/kg/日的剂量对生育力没有任何不良作用。
托特罗定是一种竞争性的毒蕈硷受体拮抗剂。膀胱收缩和唾液分泌都是由胆硷能毒蕈硷受体介导的。
口服用药后,托特罗定在肝脏中进行代谢,形成5-羟甲基衍生物。该衍生物是有药理活性的主要代谢产物。该5-羟甲基代谢产物表现出与托特罗定相似的抗毒蕈硷活性,在药
物的治疗效应中起很大作用。托特罗定及其5-羟甲基代谢产物对毒蕈硷受体都表现出很高的特异性,因为两者对其它神经递质受体和其他潜在的细胞靶位如钙通道的活性或亲和力可以忽略不计。
托特罗定对膀胱功能有突出的作用。分别测定托特罗定速释片(Immediate Release, IR)在健康志愿者中单剂量6.4mg 用药前和用药后1 小时、5 小时,对尿流动力学参数的作用。托特罗定用药后1 小时和5 小时的主要作用是增加了残余尿量,反映了膀胱的不全排空以及逼尿肌压力的降低。这些发现与其对下尿路的抗毒蕈硷作用一致。
致癌作用、致突变作用、生育力损害
在小鼠和大鼠中对托特罗定速释片进行了致癌性研究。在小鼠(30mg/kg/日)、雌性大鼠(20mg/kg/日)和雄性大鼠(30mg/kg/日)的最大耐受剂量下,托特罗定的AUC 值分别为355,291 和462μg·h/L。相比之下,2mg 剂量每日2 次用药后,人体内的AUC 值估计为34μg·h/L。因此,致癌性研究中托特罗定的暴露量比人体用药的预计暴露量高9-14 倍。小鼠和大鼠中的肿瘤均未见增多。
整套体外试验,包括4 株鼠伤寒沙门菌和2 株大肠埃希菌中的细菌突变试验(Ames 试验),L5178Y 小鼠淋巴瘤细胞中的基因突变试验,以及人淋巴细胞的染色体畸变试验,均未见托特罗定有致突变作用。小鼠的体内骨髓微核试验中托特罗定的结果也是阴性。
交配前2 周和妊娠期间用20mg/kg/日(对应的AUC 值约为500μg·h/L)的剂量给雌性小鼠治疗,未见对雌性小鼠的生殖能力及生育力有影响。根据AUC 值,动物的全身暴露量
约比人体暴露量高15 倍。雄性小鼠中,30mg/kg/日的剂量对生育力没有任何不良作用。
药代动力学
吸收:健康志愿者套用14C-托特罗定溶液进行的一项研究中,口服剂量为5mg,至少77%的放射标记剂量被吸收。托特罗定速释片用药后所测定的Cmax 和浓度-时间曲线下面积
(AUC)在1-4mg 的剂量範围内与用药剂量呈比例关係。根据未结合托特罗定的血清浓度及其5-羟甲基代谢产物血清浓度之和(“有活性的部分”),托特罗定缓释剂4mg,每日1 次用药的AUC 与托特罗定速释片4mg(2mg,每日2 次)的AUC 相当。托特罗定缓释剂的Cmax 和Cmin 水平分别约为托特罗定速释片的75%和150%。托特罗定缓释剂的最大血清浓度见于用药后2-6 小时。
食物的影响:食物对托特罗定缓释剂的药代动力学没有影响。
分布:托特罗定与血浆蛋白高度结合,主要是与α1 酸性糖蛋白结合。在临床研究所达到的浓度範围内,未结合托特罗定的浓度平均为3.7%±0.13%。托特罗定的5-羟甲基代谢产物与血清蛋白的结合不多,未结合部分的浓度平均为36%±4.0%。托特罗定及其5-羟甲基代谢产物的血液和血清浓度之比分别为0.6 和0.8,说明这些化合物没有广泛分布到红细胞中。
托特罗定按1.28mg 剂量静脉内用药后,其分布容积为113±26.7L。
代谢:托特罗定口服给药后经肝脏广泛代谢,主要代谢途径包括5-甲基基团的氧化,这是由细胞色素P450 2D6 酶(CYP2D6)介导的,结果形成了有药理学活性的5-羟甲基代
谢产物。进一步代谢则形成5-羧酸和N-脱烷基5-羧酸代谢产物,这两种代谢产物分别占尿中回收的代谢产物总量的51%±14%和29%±6.3%。
代谢的变异性:部分(约7%)高加索白人缺乏CYP2D6 酶,这种酶负责托特罗定5-羟甲基代谢产物的形成。发现在这些人(“弱代谢者”)中的代谢途径是通过细胞色素P450 3A4酶(CYP3A4)脱烷基形成N-脱烷基托特罗定。该人群中其他的人则被称为“强代谢者”。药代动力学研究发现,弱代谢者中托特罗定的代谢速度比在强代谢者中的代谢速度慢,这就导致托特罗定的血清浓度明显比较高,而其5-羟甲基代谢产物的浓度可忽略不计。
排泄:健康志愿者口服5mg 14C-托特罗定溶液后,7 日内尿中回收了77%的放射性标誌物,粪便中回收了17%的放射性标誌物。所回收的完整托特罗定不到给药剂量的1%(在弱
代谢者中[2.5%),所回收的放射标誌物中,5%-14%(弱代谢者中[1%)是有活性的5-羟甲基代谢产物。
表4 中总结了强代谢者(EM)和弱代谢者(PM)中托特罗定缓释剂及其5-羟甲基代谢产物药代动力学参数的平均值(±标準差)。这些数据是在17 名健康男性志愿者(13 名EM,4名PM)中,用托特罗定缓释剂单剂量和每日1 次多剂量给药后所获得的。
特殊人群中的药代动力学
年龄:在Ⅰ期多剂量给药研究中,托特罗定速释片4mg(2mg,每日2 次)用药后,老年健康志愿者(年龄64-80 岁)和年轻的健康志愿者(年龄40 岁以下)中托特罗定及其5-羟甲基代谢产物的血清浓度相似。另一项Ⅰ期研究中,老年志愿者(年龄71-81 岁)用托特罗定速释片2mg 或4mg(1mg 或2mg,每日2 次)。结果这些老年志愿者中托特罗定及其5-羟甲基代谢产物的平均血清浓度分别比年轻健康志愿者中所报告的数据高约20%和50%。
但是,在为期12 周的Ⅲ期对照临床研究中,老年患者和年轻患者使用托特罗定的总体安全性上未见差异,因此老年患者不需要调整托特罗定的用药剂量(参见【老年用药】)。
儿科:儿科人群中的疗效尚未明确。在年龄11-15 岁的儿科患者中已评价了托特罗定缓释剂胶囊的药代动力学。在所评价的剂量範围内,用药剂量与药物血浆浓度呈线性关係。母药 /代谢产物之比因CYP2D6 代谢情况的不同而有所差异:EM 受试者的托特罗定血清浓度比较低,有活性的5-羟甲基代谢产物的血清浓度比较高,而PM 受试者的托特罗定血清浓度比较高,有活性的代谢产物的浓度可忽略不计。
性别:托特罗定速释片及其5-羟甲基代谢产物的药代动力学不受性别的影响。托特罗定速释片按2mg 剂量给男性和女性受试者用药后,托特罗定速释片(男性1.6μg/L,女性
2.2μg/L)及其有活性的5-羟甲基代谢产物(男性2.2μg/L,女性2.5μg/L)的平均Cmax 在男性和女性中相似。托特罗定速释片(男性6.7μg·h/L,女性7.8μg·h/L)及其5-羟甲基代谢产物(男性10μg·h/L,女性11μg·h/L)的平均AUC 值在男性和女性中也相似。男性和女性中托特罗定速释片的消除半衰期都是2.4 小时,其5-羟甲基代谢产物的半衰期在女性中为3.0小时,男性中为3.3 小时。
种族:种族差异所致的药代动力学差异尚未明确。
肾功能不全:肾功能损害可显着改变托特罗定速释片及其代谢产物在体内的消除过程。
在肌酐清除率为10-30mL/min 的患者中开展了一项研究,发现肾功能损害患者中托特罗定速释片及其5-羟甲基代谢产物的水平比健康志愿者中的相应水平高约2-3 倍。肾功能损害患者中托特罗定的其他代谢产物(如,托特罗定酸,N-脱烷基托特罗定酸,N¬脱烷基托特罗定和N-脱烷基羟基托特罗定)的暴露水平明显高于(10-30 倍)健康志愿者中的相应水平。
对于有明显肾功能减退的患者,本品推荐剂量为每日2mg(参见【注意事项】的“一般注意事项”及【用法用量】)。
肝功能不全:肝功能损害可显着改变托特罗定速释片在体内的消除过程。在肝硬化患者中对托特罗定速释片进行了一项研究,发现托特罗定速释片在肝硬化患者中的消除半衰期(平均7.8 小时)比在健康的年轻和老年志愿者中的半衰期(平均2-4 小时)长。肝硬化患者口服托特罗定速释片后的清除率(1.0±1.7L/h/kg)明显低于健康志愿者口服用药后的清除率(5.7±3.8L/h/kg)。肝功能显着减退患者中,本品推荐剂量为每日2mg(参见【注意事项】的“一般注意事项”及【用法用量】)。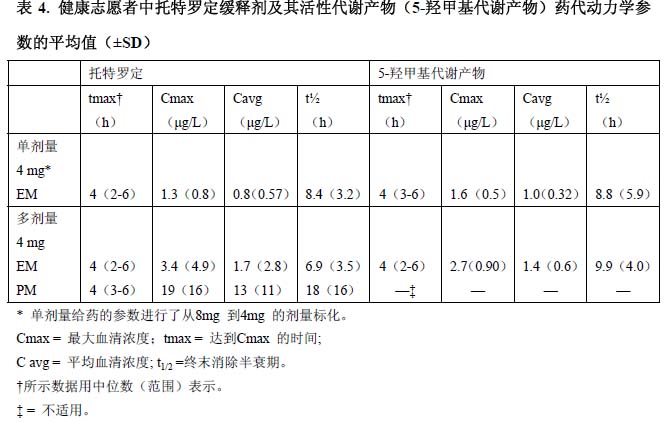
(AUC)在1-4mg 的剂量範围内与用药剂量呈比例关係。根据未结合托特罗定的血清浓度及其5-羟甲基代谢产物血清浓度之和(“有活性的部分”),托特罗定缓释剂4mg,每日1 次用药的AUC 与托特罗定速释片4mg(2mg,每日2 次)的AUC 相当。托特罗定缓释剂的Cmax 和Cmin 水平分别约为托特罗定速释片的75%和150%。托特罗定缓释剂的最大血清浓度见于用药后2-6 小时。
食物的影响:食物对托特罗定缓释剂的药代动力学没有影响。
分布:托特罗定与血浆蛋白高度结合,主要是与α1 酸性糖蛋白结合。在临床研究所达到的浓度範围内,未结合托特罗定的浓度平均为3.7%±0.13%。托特罗定的5-羟甲基代谢产物与血清蛋白的结合不多,未结合部分的浓度平均为36%±4.0%。托特罗定及其5-羟甲基代谢产物的血液和血清浓度之比分别为0.6 和0.8,说明这些化合物没有广泛分布到红细胞中。
托特罗定按1.28mg 剂量静脉内用药后,其分布容积为113±26.7L。
代谢:托特罗定口服给药后经肝脏广泛代谢,主要代谢途径包括5-甲基基团的氧化,这是由细胞色素P450 2D6 酶(CYP2D6)介导的,结果形成了有药理学活性的5-羟甲基代
谢产物。进一步代谢则形成5-羧酸和N-脱烷基5-羧酸代谢产物,这两种代谢产物分别占尿中回收的代谢产物总量的51%±14%和29%±6.3%。
代谢的变异性:部分(约7%)高加索白人缺乏CYP2D6 酶,这种酶负责托特罗定5-羟甲基代谢产物的形成。发现在这些人(“弱代谢者”)中的代谢途径是通过细胞色素P450 3A4酶(CYP3A4)脱烷基形成N-脱烷基托特罗定。该人群中其他的人则被称为“强代谢者”。药代动力学研究发现,弱代谢者中托特罗定的代谢速度比在强代谢者中的代谢速度慢,这就导致托特罗定的血清浓度明显比较高,而其5-羟甲基代谢产物的浓度可忽略不计。
排泄:健康志愿者口服5mg 14C-托特罗定溶液后,7 日内尿中回收了77%的放射性标誌物,粪便中回收了17%的放射性标誌物。所回收的完整托特罗定不到给药剂量的1%(在弱
代谢者中[2.5%),所回收的放射标誌物中,5%-14%(弱代谢者中[1%)是有活性的5-羟甲基代谢产物。
表4 中总结了强代谢者(EM)和弱代谢者(PM)中托特罗定缓释剂及其5-羟甲基代谢产物药代动力学参数的平均值(±标準差)。这些数据是在17 名健康男性志愿者(13 名EM,4名PM)中,用托特罗定缓释剂单剂量和每日1 次多剂量给药后所获得的。
特殊人群中的药代动力学
年龄:在Ⅰ期多剂量给药研究中,托特罗定速释片4mg(2mg,每日2 次)用药后,老年健康志愿者(年龄64-80 岁)和年轻的健康志愿者(年龄40 岁以下)中托特罗定及其5-羟甲基代谢产物的血清浓度相似。另一项Ⅰ期研究中,老年志愿者(年龄71-81 岁)用托特罗定速释片2mg 或4mg(1mg 或2mg,每日2 次)。结果这些老年志愿者中托特罗定及其5-羟甲基代谢产物的平均血清浓度分别比年轻健康志愿者中所报告的数据高约20%和50%。
但是,在为期12 周的Ⅲ期对照临床研究中,老年患者和年轻患者使用托特罗定的总体安全性上未见差异,因此老年患者不需要调整托特罗定的用药剂量(参见【老年用药】)。
儿科:儿科人群中的疗效尚未明确。在年龄11-15 岁的儿科患者中已评价了托特罗定缓释剂胶囊的药代动力学。在所评价的剂量範围内,用药剂量与药物血浆浓度呈线性关係。母药 /代谢产物之比因CYP2D6 代谢情况的不同而有所差异:EM 受试者的托特罗定血清浓度比较低,有活性的5-羟甲基代谢产物的血清浓度比较高,而PM 受试者的托特罗定血清浓度比较高,有活性的代谢产物的浓度可忽略不计。
性别:托特罗定速释片及其5-羟甲基代谢产物的药代动力学不受性别的影响。托特罗定速释片按2mg 剂量给男性和女性受试者用药后,托特罗定速释片(男性1.6μg/L,女性
2.2μg/L)及其有活性的5-羟甲基代谢产物(男性2.2μg/L,女性2.5μg/L)的平均Cmax 在男性和女性中相似。托特罗定速释片(男性6.7μg·h/L,女性7.8μg·h/L)及其5-羟甲基代谢产物(男性10μg·h/L,女性11μg·h/L)的平均AUC 值在男性和女性中也相似。男性和女性中托特罗定速释片的消除半衰期都是2.4 小时,其5-羟甲基代谢产物的半衰期在女性中为3.0小时,男性中为3.3 小时。
种族:种族差异所致的药代动力学差异尚未明确。
肾功能不全:肾功能损害可显着改变托特罗定速释片及其代谢产物在体内的消除过程。
在肌酐清除率为10-30mL/min 的患者中开展了一项研究,发现肾功能损害患者中托特罗定速释片及其5-羟甲基代谢产物的水平比健康志愿者中的相应水平高约2-3 倍。肾功能损害患者中托特罗定的其他代谢产物(如,托特罗定酸,N-脱烷基托特罗定酸,N¬脱烷基托特罗定和N-脱烷基羟基托特罗定)的暴露水平明显高于(10-30 倍)健康志愿者中的相应水平。
对于有明显肾功能减退的患者,本品推荐剂量为每日2mg(参见【注意事项】的“一般注意事项”及【用法用量】)。
肝功能不全:肝功能损害可显着改变托特罗定速释片在体内的消除过程。在肝硬化患者中对托特罗定速释片进行了一项研究,发现托特罗定速释片在肝硬化患者中的消除半衰期(平均7.8 小时)比在健康的年轻和老年志愿者中的半衰期(平均2-4 小时)长。肝硬化患者口服托特罗定速释片后的清除率(1.0±1.7L/h/kg)明显低于健康志愿者口服用药后的清除率(5.7±3.8L/h/kg)。肝功能显着减退患者中,本品推荐剂量为每日2mg(参见【注意事项】的“一般注意事项”及【用法用量】)。

贮藏
15-30°C 避光保存。
包装
铝塑水泡眼包装;7 粒/盒。
有效期
24 个月
执行标準
JX20070228
转载请注明出处累积网 » 酒石酸托特罗定缓释胶囊
 累积网新闻资讯
累积网新闻资讯